神経病理
日本では世界に前例のない速さで高齢化が進み、世界最高水準の高齢化率となり、どの国もこれまで経験したことのない超高齢社会を迎えています。運動ニューロン病や認知症、多系統萎縮症などの神経変性疾患は有病率が加齢とともに上昇し、高齢化に伴って患者数が増え続けています。この様な疾患のメカニズムを解明して治療法へ結びつけることは急務の課題となっています。
1.筋萎縮性側索硬化症と前頭側頭葉型認知症
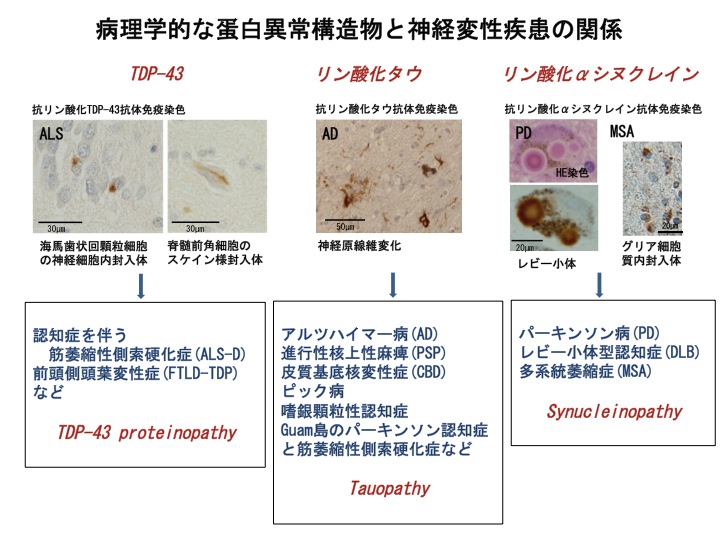
筋萎縮性側索硬化症(以下ALS; Amyotrophic lateral sclerosis)は、進行性の神経原性筋萎縮を来たす代表的な運動ニューロン疾患です。神経病理学的特徴として、下位運動ニューロンにBunina bodyや糸くず様封入体(ユビキチン免疫染色に陽性)の異常構造物が特異的に出現します。若年性認知症において2番目に多いとされる前頭側頭葉変性症(frontotemporal lobar degeneration:FTLD)は性格変化、記銘力障害、言語障害、行動異常などをひき起こす神経変性疾患であり,脳に主としてタウが蓄積するタイプと,主としてユビキチン陽性の封入体がみられるものとに大別されます。中には、ALSとFTLDの両者の症候を呈する症例(認知症を伴うALS;ALS-D)もみられます。ユビキチン陽性封入体は、ALS-DやFTLDの海馬歯状回顆粒細胞、前頭側頭葉皮質の神経細胞にも出現し、その本体は長い間不明でした。2006年に、このユビキチン陽性封入体の構造蛋白がTDP-43(TAR DNA-binding protein of 43kDa)であることが同定されてから原因解明の突破口となっています。古典的に運動ニューロンの変性および筋力の低下を示す神経変性疾患とされてきたALSでもTDP-43が蓄積していることが示され、この2つの疾患の病態および臨床症状におけるオーバーラップが指摘されるようになりました。また、TDP-43やタウ以外に、FUS (fused in sarcoma)もALSやFTLDの神経組織の残存ニューロン内に蓄積していることも明らかになっています。現在、神経病理学的亜型分類に基づくと、それぞれの蓄積する蛋白質に応じて、FTLD-TDP、FTLD-tau、FTLD-FUSなどと命名され、また、それぞれが1つの疾患スペクトラムとしてTDP-43 protenopathtyなどという概念も提唱されています。私達はこれらのproteinopathyについて、神経細胞死との関連から、運動ニューロン疾患や認知症の異常な蛋白質凝集体蓄積のメカニズムを解明する研究を行っています。また、Guam島ではかつてパーキンソン-認知症(PDC)とALSが多発し、これらの疾患ではTDP-43だけではなく同時にtauの蓄積もみられ、TDP-43 proteinopathyとtauopathyとの相互関連についての研究も進めています。
2.多系統萎縮症
多系統萎縮症(以下MSA: multiple system atrophy)は、当初オリーブ橋小脳萎縮症(OPCA: olivopontocerebellar atrophy),線条体黒質変性症(SND: striatonigral degeneration)、シャイ・ドレーガー症候群(SDS:Shy-Drager syndrome;)の3つの独立していた疾患が、臨床像や病理学的な病変分布に共通点がみられることから、包括してMSA と総称されるようになった脊髄小脳変性症に分類される疾患です。MSA の病変部位のオリゴデンドログリアの胞体内に嗜銀性封入体が同定され、glial cytoplasmic inclusion(GCI)と呼ばれています。このGCI の主要な構成蛋白はα-synuclein(以下αSN)であることが確認され、MSA はパーキンソン病(PD :Parkinson disease)、レヴィー小体型認知症(DLB: Dementia with Lewy bodies)と共にsynucleinopathyと考えられています。GCI は、オリゴデンドログリアの胞体内に形成される蛋白質凝集体で、疾患のターゲットとなる細胞は神経細胞のみではないことを示しています。MSA の病理所見は、神経変性疾患の病態を考える上で重要な鍵を与えるものです。但し、神経細胞の胞体内や核内にも封入体が出現していることも報告されており、この異常な蛋白質蓄積のメカニズムを探ることが重要です。


